临床试验机构
一、机构概况
1、临床试验机构(原药物临床试验中心,以下简称机构)成立于2016年12月21日。于峰为机构主任;贾立华为机构副主任(兼),王莉为机构办公室主任。
2、北京大学国际医院于2017年5月15日获国家食品药品监督管理总局临床试验机构资格认定证书,证书编号575,认定专业麻醉、泌尿外科、血液内科、消化内科、肾脏内科、肿瘤内科。
3、机构于2018年9月29日在国家药品监督管理局药物和医疗器械临床试验机构备案管理信息系统完成医疗器械备案,备案号:械临机构备201800291。
4、机构于2020年4月24日在国家药品监督管理局药物和医疗器械临床试验机构备案管理信息系统完成药物备案,备案号:药临床机构备字2020000206。
二、组织架构
1、机构下设机构办公室、质量管理部门,试验药房和试验资料室。
王莉为机构办公室秘书、试验药房药师;赵丽平为质量管理员、资料管理员。
2、机构管理药物备案专业9个,主要研究者11名。
血液内科专业(张梅香、欧阳敏、胡文青、江滨)、麻醉科专业(姚兰)、消化内科专业(杨雪松)、肾脏内科专业(于峰、丁嘉祥)、肿瘤内科专业(梁军、汤传昊、林莉)、泌尿外科专业(王晓峰)、Ⅰ期临床试验研究室(梁军、于峰)、淋巴瘤专业(郑文)、核医学专业(王荣福)。
3、机构管理医疗器械备案专业7个,主要研究者9名。
整形外科(韩岩),肿瘤科(梁军、汤传昊、林莉),肾病学(丁嘉祥),医学检验科(张捷),心血管内科(刘小慧)、神经外科(赵元立)、核医学(王荣福)。
三、联系方式
1、机构
| 职务 | 姓名 | 联系方式 | 电话 |
| 主任 | 于峰 | ||
| 副主任 | 贾立华 | 医技楼B1药剂科主任办公室 | 69006062、69007656 |
| 机构办公室主任 | 王莉 | 科教楼522 | 69007607 |
| 质量/资料管理员 | 赵丽平 | 医技楼7层药师办公室 | 69007655、18810532981 |
| 试验药师 | 王莉 | 肿瘤诊疗中心一层药房 | 69006782 |
2、备案专业
| 专业 | 姓名 | 联系方式 | 电话 |
| 泌尿外科PI | 王晓峰 | - | - |
| 泌尿外科秘书 | 洪欣 | hongxin@pkuih.edu.cn | 69006210 |
| 血液科PI | 江滨 | - | - |
| 血液科PI | 欧阳敏 | ouyangmin@pkuih.edu.cn | 69007613 |
| 血液科PI | 张梅香 | zhangmeixiang@pkuih.edu.cn | 69007613 |
| 血液科PI | 胡文青 | huwenqing@pkuih.edu.cn | 69007613 |
| 消化内科PI | 杨雪松 | yangxuesong@pkuih.edu.cn | - |
| 消化内科秘书 | 王丽 | wangli5@pkuih.edu.cn | 13161970759 |
| 麻醉科PI | 姚兰 | yaolan@pkuih.edu.cn | - |
| 麻醉科秘书 | 解霄燕 | jiexiaoyan@pkuih.edu.cn | 18910883617 |
| 肾脏内科PI | 于峰 | yufeng@pkuih.edu.cn | - |
| 肾脏内科PI | 丁嘉祥 | dingjiaxiang@pkuih.edu.cn | - |
| 肾脏内科秘书 | 潘玉静 | panyujing@pkuih.edu.cn | 18810558968 |
| 肿瘤内科PI | 梁军 | liangjun@pkuih.edu.cn | - |
| 肿瘤内科PI | 汤传昊 | tangchuanhao@pkuih.edu.cn | - |
| 肿瘤内科PI | 林莉 | linli1@pkuih.edu.cn | |
| 肿瘤内科秘书 | 孟超 | mengchao@pkuih.edu.cn | 69007601 |
| I期PI | 梁军 | liangjun@pkuih.edu.cn | - |
| I期PI | 于峰 | yufeng@pkuih.edu.cn | - |
| I期秘书 | 朱晨晓 | zhuchenxiao@pkuih.edu.cn | 18410071805 |
| 检验科PI | 张捷 | zhangj@pkuih.edu.cn | 69006543 |
| 检验科秘书 | 戴菊华 | daijuhua@pkuih.edu.cn | 18811772358 |
| 整形外科秘书 | 王成源 | wangchengyuan@pkuih.edu.cn | 13521124191 |
| 心内PI | 刘小慧 | liuxiaohui@pkuih.edu.cn | - |
| 心内秘书 | 姚宏英 | yaohongying@pkuih.edu.cn | 13488731778 |
| 神经外科PI | 赵元立 | zhaoyuanli@pkuih.edu.cn | - |
| 神经外科秘书 | 牛弘川 | niuhongchuan@pkuih.edu.cn | 13811183845 |
| 神经外科秘书 | 赵阳 | zhaoyang@pkuih.edu.cn | 13552313531 |
3、行政部门
| 部门 | 姓名 | 办公地点 | 电话 |
| 纪检监察与法律合规部 | 李维玮 | 5号楼802 | 69006439 |
| 财务管理部 | 王艳楠 | 5号楼903 | 69006930 |
| 党院办公室 | 王倩 | 5号楼902 | 69006984 |
| 医保办公室 | 程琪 | 门诊2层医保办公室 | 18611210607 |
4、医技科室
| 科室 | 姓名 | 邮箱、办公地点 | 电话 |
| 检验科 | 戴菊华 | daijuhua@pkuih.edu.cn | 18811772358 |
| 超声科 | 贾莹 | jiaying@pkuih.edu.cn | 13641390463 |
| 放射科 | 郭勇 | guoyong1@pkuih.edu.cn | 18600310357 |
| 病理科 | 赵姗姗 | zhaoshanshan@pkuih.edu.cn | 18811333038 |
| 核医学科 | 王玉 | wangyu1@pkuih.edu.cn | 69006340 |
| 病案室 | 梁艳辉 | liangyanhui@pkuih.edu.cn | 69006010 |
四、信息系统
1 机构使用3个系统开展临床试验的各项活动:①临床试验管理系统(CTMS)、②院内办公网(OA)、③IIH医生工作站。
1.1 机构相关工作:请项目方联系研究者,所有资料均在我院OA和CTMS系统,可以分别查阅和下载;我院所有系统均需要使用研究者的账号进行操作。
1.2 伦理相关工作:见伦理委员会公邮pkuihgcp@126.com 密码:pkuih@2017
1.3 项目方如需北京大学国际医院相关的资质及证书(包括但不限于医疗机构执业许可证、事业单位法人证书等),按照我院制度,应由研究者向党院办公室、医务部等相关部门申请。
2 临床试验机构的受控文件
2.1 机构受控文件在线查阅路径【OA→下载中心→文档下载→院内制度→临床试验机构】
2.2 机构受控文件附表下载路径【CTMS→首页→制度/模板→文档下载,在文档类别的下拉菜单中选“表单、模板和附件”→点击查询】
2.3 其他文档(合同模板、法律法规、资质、证书、每月温度记录)可以在CTMS下载,路径【CTMS→首页→制度/模板→文档下载】。
3 CTMS系统
3.1 使用院内网络可登陆系统,网址http://ctms.pkuih.edu.cn。
3.2 CTMS包含模块:试验管理、伦理审查、质控管理、药品管理、器械管理、经费管理。
3.3 用户名和初始密码均为本院员工工号,忘记密码或无法登陆时,请发邮件提供姓名和工号给机构办公室重置密码。
4 OA系统
4.1 OA相关工作包含:立项审批、合同审批、财务审批。详见下文。
5 IIH医生工作站
5.1 机构质量管理员在完成启动质控后为各项目开通科研账号并发送给Key Sub-I。
5.2 在合同内的检查检验等费用,统一由科研账号开具,直接扣除项目账户内的试验费用。合同外的费用,不得由IIH科研账号支付。
五、立项
1 立项制度
1.1《PKUIH-LCSY-Ⅱ-ZD-3临床试验机构_项目管理制度》
1.2 立项相关工作联络人:王莉 69006782、69007607。
2 立项流程
2.1 项目方准备项目方相关的资料;项目方联络人使用研究者的CTMS账号或到机构办公室处,在CTMS系统登记公司信息和个人信息,在机构办公室加入”PKUIH_临床试验_项目方群”微信联络群。群内有管理人员(机构主任、机构办主任、秘书、机构质量管理员、伦理委员会秘书、审计法务部联系人、财务部联系人)和项目方人员。项目方人员入群后请修改昵称为:项目编号+CRA+姓名、项目编号+CRC+姓名。
2.2 我院研究者①在OA提交立项审批【OA→临床试验立项管理→临床试验立项申请】;②在CTMS发起立项申请并上传立项资料【CTMS→试验管理→试验立项→立项申请】,填写所有内容(不分必填和选填),必须填写申办方;③完成前两步后,将纸版资料交机构办公室。
2.3 机构办公室对项目进行风险评估评分,OA系统同意;承接科室主任OA系统同意;机构办公室主任审阅纸版资料,OA系统同意;机构主任OA系统同意;机构秘书在CTMS系统审核通过,生成项目编号,在OA系统录入编号,立项完成。
3 研究者简历编辑
3.1 研究者需完善个人简历,路径【CTMS→首页→我的信息→个人简历】。
3.2 基本信息:应尽可能录入完整;教育经历:填写本科及以上学历和/或学位;工作经历:依次填写毕业后的工作单位。
3.3 培训经历:点击“新建”,逐条录入参加过的每一次院外、院内培训、自学承诺书等;部分培训可能缺少证书编号等项,此种情况可不填写,其余信息尽可能填完整;院内培训证书有效期为3年。研究者按需参加由机构办公室于2023年8月1日经全院邮件发送的《关于开展临床试验质量管理规范(GCP)网络培训的通知》,获得证书后及时更新培训经历。【注:当培训经历中录入了GCP级别、证书号和取得日时,基本信息栏内会随之更新至最新版的证书】
3.4 附件资料:上传执业证书(姓名页和执业地点页),培训经历中的所有证书扫描件,扫描件清晰可读。
3.5 打印→本人签名、签日期。
六、合同
1 合同制度
1.1 《PKUIH-LCSY-Ⅱ-ZD-5临床试验机构_合同管理制度》
1.2 法务相关工作联络人:李维玮(法务部门只对接我院研究者,不接待项目方人员)
2 主合同、补充合同:
2.1 我院统一收取管理费,管理费计算方法见合同模板中《LCSY-Ⅱ-ZD-6-BD-10临床试验合作协议费用表》(我院最新版本的合同模板已于2024年9月上传至CTMS系统中,请使用最新模板)。
2.2 推荐在CTMS下载机构提供的合同模板,也可使用项目方的合同模板。如使用项目方模板,请于合同最后增加一个附表,此表为我院合同模板中《PKUIH-SJFW-GSHT-3临床试验项目合作协议书》,并将符合项目的金额录入,不符合项目可在“其他”内录入。表格会自动计算税费、管理费,并生成总费用。
2.3 乙方为北京大学国际医院。我院合同签字人员有:项目主要研究者,我院法人/院长梁军。
2.4 合同份数:一式多份,我院留3份(院办1份,机构办公室1份,主要研究者1份)。
3 CRC协议
3.1 机构无固定合作SMO公司。
3.2 机构不强制必须签署CRC协议。项目方如需要,可我院签署CRC协议。
3.3 机构不收取CRC管理费。
4 合同审批
4.1 项目必须获得伦理委员会批件后,机构才开始审阅合同。
4.2 研究者从OA系统发起GCP合同审批流【OA→合同管理→合同相关审批单→GCP合同审批单】。依次经财务部、科主任、审计法务部和机构办公室主任、机构主任、院长办公室审阅合同。
4.3 线上合同审批时限:使用我院模板的,约1周完成;未使用我院模板的,根据合同复杂程度,约3周完成。使用院外模板的,在上传OA前,建议研究者通过邮件发送给审计法务部进行预审。财务部和机构办公室不参与提前审阅步骤,所有内容均在OA线上审阅。
5 合同盖章及备案
5.1 甲方签名、盖章→主要研究者签名、日期→院长签名、日期(可交机构办公室处,盖院长签名章)→审计法务部盖复核章(二区1号楼802)→院办盖合同章(二区1号楼902院长办公室,留1份原件)→机构办公室(给机构办公室交1份原件)。也可我院先签名盖章再交甲方。
5.2 机构办公室上传扫描终版至CTMS系统。项目方和研究者可与机构质量管理员预约启动会。
七、财务
1 财务制度
1.1《PKUIH-LCSY-Ⅱ-ZD-6临床试验机构_经费管理制度》
1.2 财务相关工作联络人:王艳楠 69006930
2 财务信息
户名:北京大学国际医院
开户行:中国银行北京人大支行
账号:345464819555
行号:104100005694
医院纳锐人识别号:121100005890627486
3 经费管理
3.1经费入账:财务部收到账款后,甲方前往财务部开具发票后,于CTMS系统登记到账。
3.2经费使用:
3.2.1受试者检查费使用:由IIH系统的科研医嘱开具,IIH系统施行费用总控,超费时账号停用。医保患者纳入临床试验时,在相关费用使用前,研究者应与医保办公室先行沟通具体报销事宜,联系人及联系方式请见《三、联系方式》。
3.2.2研究者观察费、受试者补偿费、研究助理费、办公费、试验材料费、研究者交通费、组长单位费、其他费用的支取步骤:
1) 研究者发起支出登记【CTMS→经费管理→试验经费支出申请】;经机构秘书和财务部审核通过,导出《临床试验项目经费申领单》。
2) 研究者发起付款申请【OA→财务管理→请示→GCP付款申请单】;上传已签署协议中的《LCSY-II-ZD-6-BD-10临床试验合作协议费用表》扫描件、CTMS系统的《临床试验项目经费申领单》、《LCSY-II-ZD-6-BD-12临床试验项目经费支付明细表》;依次经临床试验机构秘书,临床试验机构办公室主任,临床试验机构主任审批后,按院内财务制度流程审批并付款。
3.3 当项目结题或因特殊情况中止时,需由专业科室提交退款申请至财务部,财务部将未使用的净值总额、管理费和税费退还甲方。
4 受试者补助领取事项
4.1 自2022年5月1日起,受试者补偿费(营养费)和受试者交通费不再接受发票报销方式,直接按劳务费形式发放,我院代扣代缴受试者个人所得税。
4.2 我院提供个税告知书模板,建议在受试者签署知情同意书时,由研究者或项目方告知受试者。《LCSY-II-ZD-6-BD-11临床试验个税告知书》模板Word版可在CTMS系统下载。
八、人遗
1 按《中华人民共和国人类遗传资源管理条例(国令第717号)》、《中国人类遗传资源国际合作临床试验备案范围和程序》办理
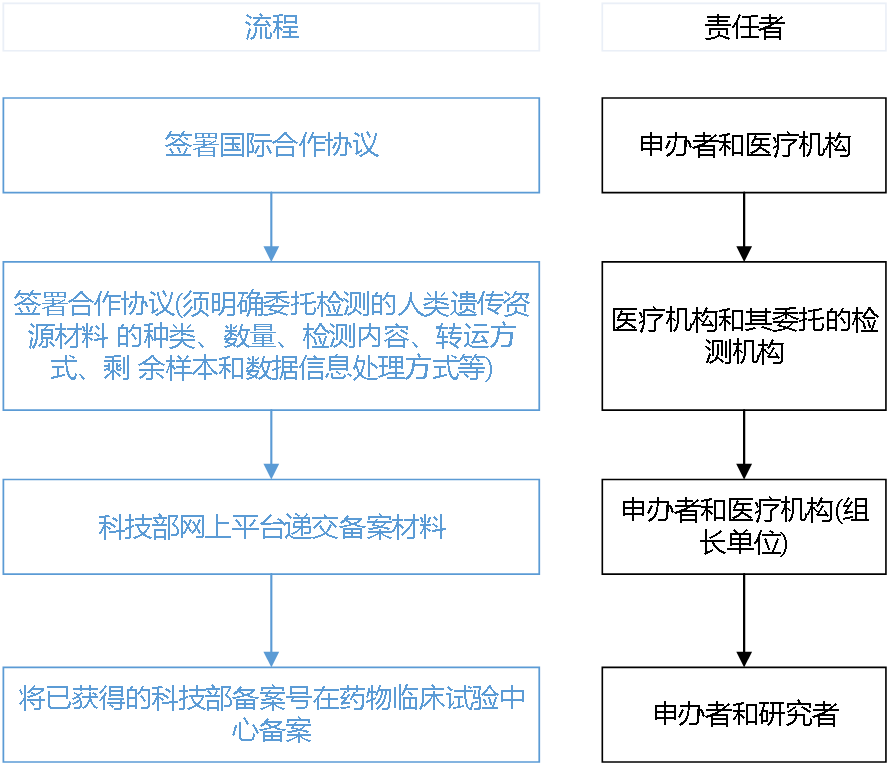
2 承诺书盖章,按照我院制度,应由研究者向院长办公室申请用章(公章、合同章、法人手章等),研究者持承诺书至二区1号楼912院长办公室盖章,再盖法人手签章。如无特殊情况,当天即可完成盖章。
九、启动会
1 启动会制度和SOP
1.1 《PKUIH-LCSY-Ⅱ-ZD-10临床试验机构_质量管理制度》《PKUIH-LCSY-Ⅲ-SOP-5质量管理的SOP》
1.2 启动会相关工作联络人:赵丽平 69007655、18810532981。
2人遗和合同,可以在启动会前同时开展。
3 启动会前需完成
3.1 主合同签署完成并上传于CTMS系统;
3.2 人遗批件于机构办公室备案(如涉及)。
4 启动会参加人员
4.1 主要研究者及其他所有将被授权的研究人员;
4.2 机构质量管理员,试验药师(受试品为药物的项目)。
5 启动会质控及CTMS系统填报
5.1 研究者根据试验实际情况,按照CTMS中启动质量检查任务模板中的条目,对启动相关工作进行质量检查,检查结果填入CTMS系统,具体操作如下:质控管理→质控任务→质控填报→新建任务→模板编号(模板名称:启动质量检查)→任务名称(填写:启动质量检查)→填报→提交。
5.2 完成启动质量检查任务后,研究者在试验管理中提交试验启动申请:填写启动信息、上传所有符合质控要求的附件(不适用项内容除外,质控要求详见5.1中启动质量检查任务条目);
5.3 机构质量管理员对试验启动进行质量检查:检查内容反馈-整改回复-复核结果均在CTMS系统内进行。机构质量管理员参加启动会,并对启动会进行现场检查→会后核对启动申请内的附件材料与研究者填报的启动质量检查质控记录→根据检查结果填报机构-启动相关质量检查任务→研究者整改回复(如需要整改,同时把启动申请退回,此时研究者需要对附件进行补充更新后再提交)→机构质量管理员复核→复核通过后在CTMS系统内同意试验启动。需要科研账号的试验项目,机构质量管理员在CTMS系统同意试验启动的同时在IIH系统内开立科研账号。
5.4 启动会后根据授权分工表,在CTMS系统为各项目添加人员;根据实际授权,及时变更CTMS系统信息。
5.5 研究者每一次被授权参加项目,建议在被授权日登陆CTMS打印个人简历签名签日期,以保证简历是最新版本;根据项目需要,打印附件资料中的执业证、培训证书等。
十、试验药房
1 试验用药品管理制度和SOP
1.1 《PKUIH-LCSY-Ⅱ-ZD-9临床试验机构_试验产品管理制度》《PKUIH-LCSY-Ⅲ-SOP-2试验产品管理的SOP》
1.2 药品相关工作联络人:王莉。第二试验药师:付晓玲69006061。
2 试验药房条件
2.1 试验用药品由试验药房统一管理,试验药房位于肿瘤诊疗机构一层,面积50㎡,办公电话69006782。
3 软件系统
3.1 环境温度25℃以下,2台2-8℃冰箱。每年计量1次。
3.2 冷链管理系统自动记录冰箱和环境的温湿度:记录频率为5min/次,如果10min内有5min温度持续超过上限或者下限,则产生一条报警信息(同一设备的报警在60min内不会重复产生),当温度恢复,并持续10min,则报警恢复,发送一条恢复短信。
3.3 每月初药师导出上月日极限温度记录,并上传于CTMS系统;每年定期由药师上传《冷链校准报告》至CTMS系统;下载路径【CTMS→首页→制度/模板→资质、证书下载】。
4 药品接收、发放、回收、退回管理
4.1 试验用药物在启动会前或启动会后寄到我院均可。药物临床试验在启动会后,项目方人员需到试验药房,在CTMS系统登记药品及包装相关信息并确认适宜的存储位置。
4.2 药物接收后,试验药师告知项目方人员,后者需到药房做二次核对(温度记录;药品编号、批号、效期;实物-条形码-药品接收单信息一致)
4.3 试验药师按处方发放药品,按回收单回收药品,未用药品统一退回申办者,我院不做销毁处理。由试验药师从CTMS导出明细,项目方人员核对后,寄走药物。
4.4 由CTMS产生的与药物相关的所有文件均放在试验药房项目文件夹内。
十一、质量管理
1 质量管理制度和SOP
1.1 《PKUIH-LCSY-Ⅱ-ZD-10临床试验机构_质量管理制度》《PKUIH-LCSY-Ⅲ-SOP-5质量管理的SOP》
1.2 质量相关工作联络人:赵丽平 69007655、18810532981。
2 CTMS系统
2.1 机构和专业/项目质量检查的问题记录、整改、反馈,均在我院CTMS内进行;
2.2 机构质控收到启动申请后,为试验项目分别制定机构和专业/项目的质量检查计划,以便相关质量检查人员在特定的节点进行质量检查记录;
2.3 质量检查的检查/整改/复核人员及日期默认为实际操作CTMS系统相关工作的人员及日期;
2.4 质控整改和复核时限均为2周。
3 机构质量检查流程(具体检查内容可见CTMS质控模板)
3.1 启动相关质量检查:详见启动会。
3.2 试验实施期间日常检查:首例质量检查、中期(入组1/3)质量检查等重要节点质量检查,或进行专项质量检查;
3.3 试验结题相关检查:项目结题自查→CTMS系统申请结题→机构结题质量检查→资料归档(完成临床试验项目结题签认表)→机构办公室主任/机构主任审核机构结题质量检查报告等资料→小结表结题盖章;
3.4 试验中期评估相关质量检查(不适用则忽略):项目中期评估质量自查→机构中期评估质量检查→机构办公室主任/机构主任审核机构中期评估质量检查报告等资料→中期评估小结表盖章;
3.5 以上“启动、首例、中期(入组1/3)、结题、中期评估”试验重要节点需要联系机构质量管理员赵丽平 69007655、18810532981。
十二、资料/档案管理
1 资料档案管理制度和SOP
1.1 《PKUIH-LCSY-Ⅱ-ZD-11临床试验机构_档案管理制度》《PKUIH-LCSY-Ⅲ-SOP-6档案管理的SOP》
1.2 资料档案相关工作联络人:赵丽平 69007655、18810532981。
2 硬件设施
2.1 资料室位于科研楼521。
2.2 我院提供免费存储资料服务,免费服务年限为GCP中规定的时间。超出免费时间段后,我院收取资料存储费。我院优先建议申办者将项目资料存储于第三方机构。如申办者选我院存储,存储标准为按100元/例/年(不含税),拟定主合同时一同计算。 3 资料归档流程
3.1 机构质控员完成结题质量检查→研究者在CTMS系统提交归档目录申请→试验资料移交机构试验资料室存档证明(非机构必须要求,若科室或公司需要可以打印签字)→机构资料管理员检查归档资料→资料归档确认→签署临床试验项目结题签认表。
十三、项目方人员管理
1 制度《PKUIH-LCSY-Ⅱ-ZD-8临床试验机构_项目方人员管理制度》
1.1 项目方人员人员持纸版文件至机构秘书处进行备案,文件包括公司出具的派遣函,使用我院模板《LCSY-II-ZD-8-BD-15项目方人员派遣函》;个人履历和GCP培训证书的复印件(本人签名、日期)。
1.2 在CTMS系统录入备案、变更。
2024年10月12日
专业团队
版权所有:北京大学国际医院 京ICP备15061976号